
Содержание
- этапы
- Способ 1 Изучите правила растворимости
- Метод 2 из 2: Используйте мнемонику: NAG SAG
- Метод 3 из 3: Основы обучения
Растворимость соединения - это его способность растворяться в воде. Нерастворимое соединение будет образовывать осадок в растворе. Частично растворимое соединение также считается химически нерастворимым. Если вы помните правила растворимости, вам будет легче работать с химическими уравнениями. С небольшим временем, работой и некоторыми мнемоническими уловками, вы будете помнить все формулы.
этапы
Способ 1 Изучите правила растворимости
-

Соли группы 1А растворимы. Периодическая таблица элементов организована в строки и столбцы, которые называются «периоды» и «группы» соответственно. Первый столбец таблицы содержит элементы группы 1А. Это щелочные металлы. К ним относятся элементы Li, Na, K, Cs и Rb.- Пример: KCl и LiOH растворимы в воде.
-

Соли нитратов, хлоратов и ацетатов растворимы. Когда нитрат (формулы NO3), хлорат (формула ClO3) или чередование (формулы CH3COO) образуют соли, они становятся растворимыми в воде.- Пример: KNO3NaClO3 и СН3Куна все растворимы.
-

Все соли аммония растворимы. Аммониевый лев (формула NH4) образует соли, которые полностью диссоциируют в воде. Из этого правила нет исключений.- Пример: NH4ОН растворим, даже если он содержит гидроксид-ион.
-
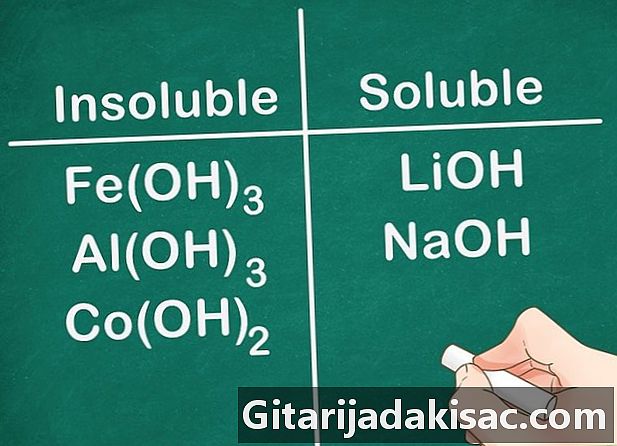
Большинство гидроксильных соединений нерастворимы. Некоторые гидроксидные соли слабо растворимы. Это случай гидроксидов, образованных с элементами группы 2 (Ca, Sr и Ba). Гидроксидные соли, образованные с элементами группы 1, являются исключением, поскольку эти элементы все еще растворимы.- Пример: Fe (OH)3Al (OH)3 и Co (OH)2 нерастворимы, но LiOH и NaOH растворимы.
-
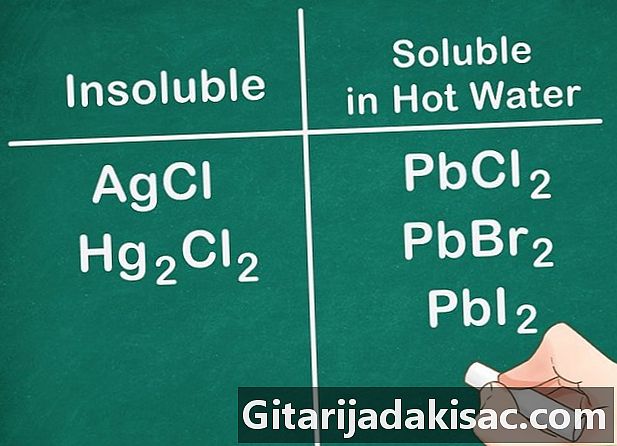
Неметаллические соли группы 17 обычно растворимы. Неметаллы группы 17 включают хлор (Cl), бромид (Br) и лиод (I). Деньги, свинец и ртуть являются исключениями из этого правила. Соединения, состоящие из этих неметаллов и этих ионов, не растворимы.- Пример: AgCl и Hg2Cl2 оба нерастворимы.
- PbCl2, PbBr2 и PbI2 растворимы в ОЧЕНЬ ГОРЯЧЕЙ воде.
-
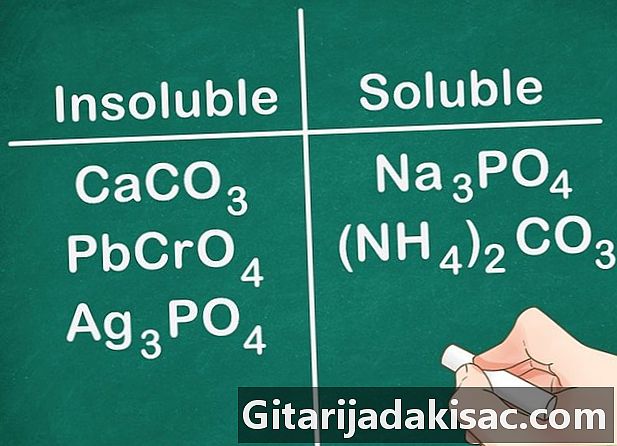
Большинство карбонатов, хроматов и фосфатов нерастворимы. Химические формулы для этих элементов: СО3 (карбонаты), CrO4 (хроматы) и ПО4 (Фосфаты). Металлы группы 1А и соединения NH4 исключение и разрешимы.- Пример: соединения, такие как CaCO3, PbCrO4 и Ag3ПО4 все нерастворимы, тогда как такие соединения, как Na3ПО4 и (NH4)2Колорадо3 растворимы
-
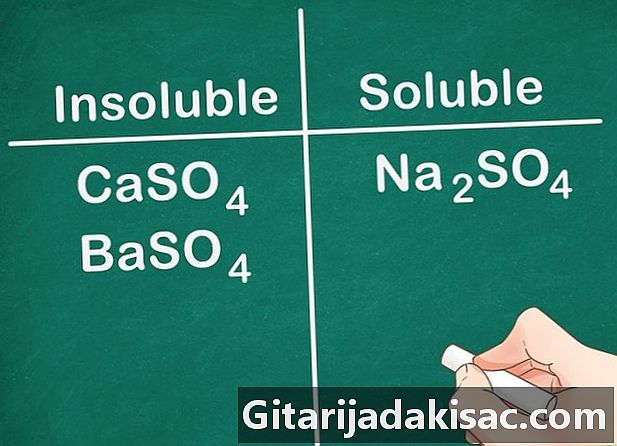
Большинство сульфатных солей растворимы. Большинство солей, включая ион SO4 растворим в воде. Ca, Ba, Pb, Ag, Sr и Hg являются исключениями из этого правила. Сульфатные соли, содержащие эти ионы, не растворимы.- Пример: Na2SO4 полностью растворим в то время как CaSO4 и BaSO4 не растворимы
-

Большинство соединений серы нерастворимы в воде. Барий, кальций, магний, натрий, калий и аммоний являются исключениями из этого правила. Только составы, сделанные из этих элементов и сульфида, растворимы в воде.- Пример: CdS, FeS и ZnS все нерастворимы.
- Однако сульфиды переходных металлов нерастворимы.
Метод 2 из 2: Используйте мнемонику: NAG SAG
-

Используйте мнемонику NAG SAG. Лакроним NAG SAG - это простой способ запомнить растворимые соединения и исключения. Напишите имя NAG SAG и запомните значение каждой буквы. Этот метод не исключает все правила растворимости, но охватывает значительную их часть. Все буквы представляют растворимые молекулы.- N: нитраты (НЕТ3)
- A: ацетаты (CH3COO)
- G: щелочные металлы группы 1 (Li, Na и др.)
- S: сульфаты (SO4)
- A: ионы аммония (NH4)
- G: неметаллы группы 17 (F, Cl, Br, I и т. Д.)
-

Запомните имя PMA для первого исключения. P представляет собой Pb (свинец). М представляет Меркурий (Hg2). А представляет Серебро (Ag). Эти три иона никогда не растворимы с сульфатной группой или неметаллами группы 17.- Когда вы заметите мнемонический трюк, нарисуйте звезду рядом с аббревиатурой PMA и аналогичную звезду возле S и G SAG, чтобы напомнить вам, что они являются исключениями.
-

Вспомните слова «Кастро» и «Бар» для второго исключения. Это может звучать глупо, но эти слова помогут вам вспомнить ионы кальция (Ca, стронций (Sr) и барий (Ba)). Эти три иона никогда не растворяются в сульфатах.- Сделайте крестик рядом с этими словами и еще один крестик возле S SAG, чтобы помнить, что эти ионы являются исключениями для растворимости сульфата.
Метод 3 из 3: Основы обучения
-

Обзор часто. Запоминание информации всегда требует времени и работы. Чем больше вы читаете свои уроки, тем больше вы будете помнить в долгосрочной перспективе. Часто пересматривайте правила и ежедневно проверяйте себя на предмете.- Попросите друзей или семью задать вам вопросы по этой теме на обед или ужин.
- Держите копию правил под рукой для ознакомления, когда у вас есть свободное время.
-

Составьте сводные листы и используйте их. Карты являются отличным средством для быстрого пересмотра предмета и его запоминания. Обратите внимание на правила растворимости на картах с некоторыми примерами. Просмотрите листы, пока не ознакомитесь с правилами и названиями растворимых и нерастворимых соединений.- Возьмите свои карты с собой и возьмите их для проверки в машине или в ожидании ваших друзей.
- Все возможности хороши для просмотра ваших объявлений.
-

Используйте мнемонические средства. Мнемонические инструменты - это советы, которые помогут вам быстро и легко запомнить информацию. Когда вы изучаете мнемонический термин, может быть полезно написать его несколько раз, чтобы запомнить его. Мнемонические трюки полезны, только если вы знаете, что означает каждая буква!- Потренируйтесь писать аббревиатуры и что означает каждое письмо.
- Когда вы находитесь на рассмотрении, сначала обратите внимание на мнемонические советы для дальнейшего использования.